Virenfreigabe Markt GRÖSSEN- UND MARKTANTEILSANALYSE - WACHSTUMSTRENDS UND PROGNOSEN (2024 - 2031)
Virenfreigabe Markt wird nach Art der Skala der Operation (Discovery Phase, Preclinical Phase, Clinical Phase), nach Art der Methode der Viral Clearan....
Virenfreigabe Markt Größe
Marktgröße in USD Bn
CAGR10%
| Studienzeitraum | 2024 - 2031 |
| Basisjahr der Schätzung | 2023 |
| CAGR | 10% |
| Marktkonzentration | Medium |
| Wichtige Akteure | Charles River Laboratories, Kreative Biolabs, Eurofins Wissenschaftlich, Mikrobac Laboratorien, MilliporeSigma und unter anderem |
Bitte lassen Sie es uns wissen!
Virenfreigabe Markt Analyse
Der Viral Clearance Market wird geschätzt auf USD 0.9 Bn in 2024 und wird voraussichtlich erreichen USD 1,7 Mrd.Wachstumsrate (CAGR) von 10% von 2024 bis 2031. Der Markt hat in den letzten Jahren ein stetiges Wachstum erlebt, das durch die zunehmende Nachfrage nach der Entwicklung sicherer und wirksamer Biologik und Therapien getrieben wurde.
Der Markt wird voraussichtlich ein positives Wachstum über den Prognosezeitraum erwarten, der durch steigende Prävalenz von viralen Infektionskrankheiten weltweit und zunehmende FuE-Investitionen in der biopharmazeutischen Industrie für die Arzneimittelentwicklung unterstützt wird. Darüber hinaus wird erwartet, dass strenge regulatorische Leitlinien für die Sicherheit von Biotherapeutika und die zunehmende Einführung von viralen Clearance-Tests während der Drogenentwicklung und -herstellung das Marktwachstum in den nächsten Jahren ergänzen.
Virenfreigabe Markt Trends
Markttreiber - steigende Nachfrage nach Viral Clearance Testing aufgrund des Aufstiegs in Biologics und Biopharmaceuticals
Die Nachfrage nach viralen Clearance-Tests hat in den letzten zehn Jahren vor allem durch die zunehmende Produktion und Vermarktung von komplexen Biologen und Biopharmazeutika deutlich zugenommen. Biologen wie monoklonale Antikörper, rekombinante Proteine, Gen- und Zelltherapien haben die Behandlung von mehreren chronischen und lebensbedrohlichen Krankheiten revolutioniert. Biologiken stammen jedoch aus lebenden Zellen und Organismen, die sie bei der vor- und nachgelagerten Verarbeitung sehr anfällig für virale Verunreinigungen machen. Selbst Spurenmengen von Virus können große Chargen möglicherweise verunreinigen, wodurch die Patientensicherheit beeinträchtigt wird. In Anbetracht der gefährdeten Patientenpopulationen, die durch diese lebenserhaltenden Therapien zielen, haben Pharmaunternehmen und Regulatoren Qualitätsstandards verschärft, die eine erschöpfende Prüfung auf mehreren Stufen erfordern, um virale Verunreinigungen zu erkennen und zu beseitigen.
Darüber hinaus umfasst die Herstellung von Biologen komplexe, mehrstufige Herstellungsverfahren im Vergleich zu herkömmlichen kleinen Moleküldrogen. Live-Zell-basierte Plattformen und Expressionssysteme werden häufig während der vorgelagerten Entwicklung und Massenproduktion genutzt. Dies erhöht das Risiko der Einführung, Persistenz oder Reaktivierung von Viren. Darüber hinaus beruht die Biologik-Produktion häufig auf primären menschlichen oder tierischen Zellen und Geweben, die endogene Retroviren und andere Krankheitserreger beherbergen können. Alle diese Faktoren beauftragen umfangreiche virale Charakterisierung, Validierung und Clearance-Studien während des gesamten Entwicklungszyklus, um Produktreinheit und Sicherheit zu gewährleisten. Die großen Chargengrößen und streng geregelte Release-Spezifikationen für Biologik bedeuten, dass selbst ein einziger Produktionsbetriebsausfall erhebliche finanzielle Auswirkungen für die Hersteller haben kann. Daher bildet virale Sicherheitsprüfung einen entscheidenden Teil der strengen Qualitätskontrollverfahren, die von Organisationen etabliert werden.
Markttreiber - Fortschritte in Viral Clearance Technologies wie Next-Generation Sequencing
Der virale Clearance-Markt hat eine bemerkenswerte Transformation erlebt, die von schnellen Fortschritten in der nächsten Generation sequncing (NGS) basierten Technologien angetrieben wird. Traditionell bildeten PCR- und Elektronenmikroskopie während der Produktreinigung und Charakterisierung die wichtigsten analytischen Lösungen für die Viruserkennung und -identifizierung. Diese Ansätze haben jedoch eine begrenzte Empfindlichkeit, um Spurenverunreinigungen aufzudecken oder neue Viren zu entdecken. Sie sind auch nicht in der Lage, volle genomische Fingerabdrückung für eine abschließende virale Charakterisierung erforderlich. Andererseits überwindet die Sequenzierung der neuen Generation mehrere Engpässe herkömmlicher Methoden durch ihre Fähigkeit, hohe Mengen von Sequenzdaten aus komplexen viralen Metagenome zu erzeugen. Die erweiterte Probenvorbereitung in Verbindung mit massiver paralleler Sequenzierung ermöglicht ein umfassendes virales Screening mit unvergleichlicher Tiefe und Breite.
NGS-Assays haben virale Spielfähigkeiten durch unübertroffenes Multiplexen und niedrige Nachweisgrenzen im Bereich von wenigen viralen Kopien revolutioniert. Sie können gleichzeitig auf eine breite Palette bekannter Viren testen und bei Prozessoptimierung, Charakterisierung und Produktfreigabe neue oder Variantenerreger entdecken. Mit Sequenzdaten und viralen Genomkarten als Fingerabdrücke können auch hochdivergierende oder genetisch veränderte Viren genau identifiziert werden. Es erleichtert auch eine hochauflösende genomische Analyse, Stammverfolgung und Mutation Überwachung und unterstützt detaillierte Wurzel verursachen Untersuchungen bei jeder Detektion. Mit stetig sinkenden Kosten werden skalierbare NGS-Workflows in großen Biomanufaktur-Hubs zunehmend traditionelle Techniken ersetzen. Ihre Umsetzung gewährleistet eine zukunftssichere virale Charakterisierung, die mit sich schnell entwickelnden Branchen und regulatorischen Erwartungen zusammenhängt.
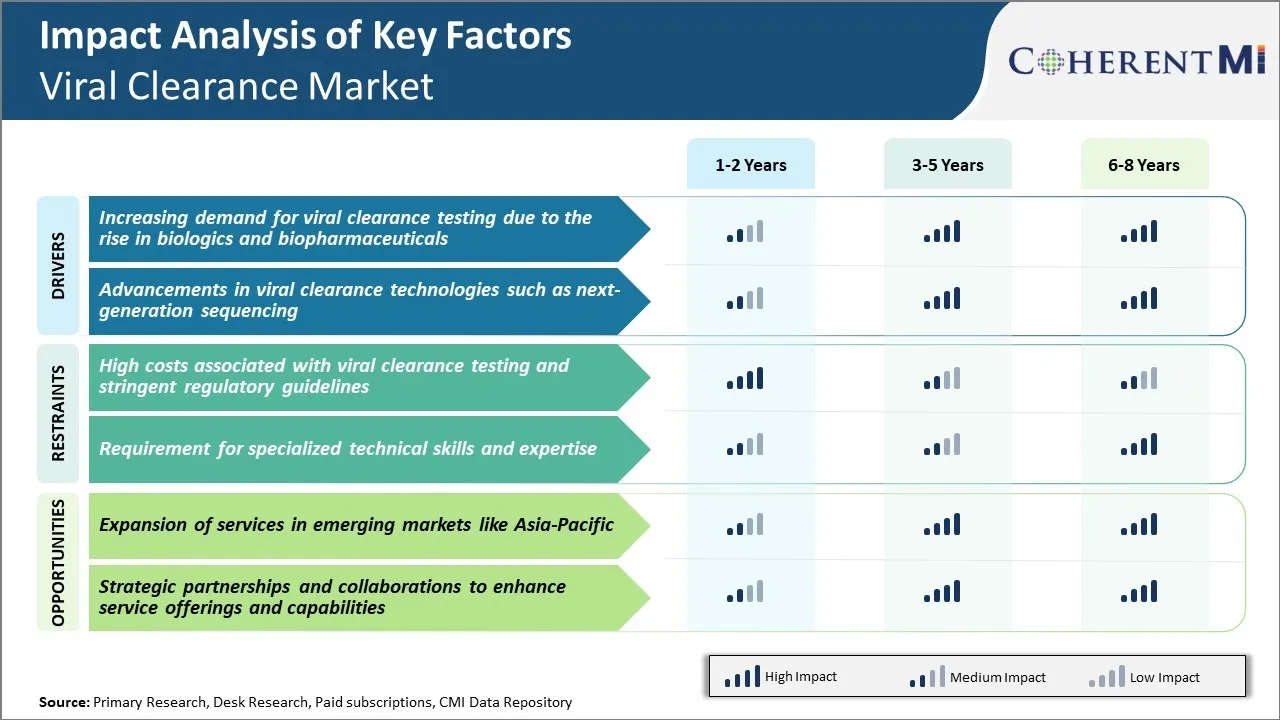
Marktherausforderung - Hohe Kosten verbunden mit Viral Clearance Testing und Stringent Regulatory Guidelines
Der virale Clearance-Markt steht vielen Herausforderungen wegen der hohen Kosten im Zusammenhang mit viralen Clearance-Tests sowie strengen regulatorischen Richtlinien gegenüber. Virale Clearance-Tests erfordern spezialisierte Geräte und Biosicherheitseinrichtungen, um lebende Viren zu behandeln, was zu deutlich hohen Kapital- und Betriebskosten für Unternehmen, die diese Dienstleistungen anbieten, beiträgt. Zusätzlich beinhaltet der Testprozess mehrere analytische Techniken wie PCR, ELISA, etc., um Viren genau zu erkennen und zu entfernen, wodurch der Gesamtprozess sehr teuer ist. Diese hohen Kosten werden letztlich an biopharmazeutische Kunden in Form von hohen Servicekosten weitergegeben. Darüber hinaus haben strenge Vorschriften von Regulierungsbehörden wie FDA und EMA den Zulassungsprozess immer komplexer gemacht. Unternehmen müssen umfangreiche Daten aus gut gestalteten viralen Validierungsstudien gemäß ICH-Richtlinien vorlegen, um ihre Produkte zu bewilligen. Diese strenge Regulierungsaufsicht hat die Compliance-Bürgschaft für Marktteilnehmer erhöht. Mit steigenden FuE-Investitionen von biopharmazeutischen Unternehmen wirken sich die Prüfkosten negativ auf ihre Gewinnspannen aus.
Marktchance: Erweiterung der Dienstleistungen in Schwellenländern wie Asien-Pazifik
Es gibt eine große Chance für virale Clearing-Dienstleister, ihre Dienste in aufstrebenden asiatischen Märkten wie Indien, China, Südkorea und anderen zu erweitern. Die Region Asien-Pazifik ist einer der am schnellsten wachsenden Pharmamärkte weltweit mit zunehmender Biologikproduktion durch lokale Firmen. Es gibt erhebliche Auslagerungen von Bioanalysen und präklinischen Sicherheitstests nach Asien durch große multinationale Biounternehmen aufgrund niedrigerer Kosten. Dies stellt ein großes ungenutztes Potenzial für virale Clearance Testing-Unternehmen dar. Durch die Einrichtung von Testanlagen und die Zusammenarbeit mit lokalen Testunternehmen in diesen asiatischen Ländern können globale Virusfreigabe-Spieler geringere Betriebskosten nutzen und auf die wachsende Kundennachfrage eingehen. Mehrere asiatische Regierungen implementieren auch günstige Strategien zur Förderung der lokalen Biosimilar-Produktion und FuE. Dies führt zu den Wachstumsaussichten des viralen Clearingmarktes in der Region Asien-Pazifik.
Wettbewerbsübersicht von Virenfreigabe Markt
Zu den wichtigsten Akteuren des Viral Clearance Market gehören Charles River Laboratories, Creative Biolabs, Eurofins Scientific, Microbac Laboratories, MilliporeSigma, Nelson Labs, Syngene International, Texcell, Vironova und WuXi Biologics.
Virenfreigabe Markt Marktführer
- Charles River Laboratories
- Kreative Biolabs
- Eurofins Wissenschaftlich
- Mikrobac Laboratorien
- MilliporeSigma
Virenfreigabe Markt - Wettbewerbsrivalität

Virenfreigabe Markt
(Von großen Akteuren dominiert)
(Hoher Wettbewerb mit vielen Akteuren.)
Neueste Entwicklungen in Virenfreigabe Markt
- Im Juni 2023 erhielten Cytiva und BioCentriq 15,8 Mio. USD von NIIMBL, um eine virale und exotoxinfreie Plattform zu entwickeln.
- Im Juni 2023 eröffnete Texcell eine Testanlage in Nordamerika, um die virale Sicherheit von Biotherapeutika zu verbessern.
- Im Juni 2023 arbeitete Valo Therapeutics mit Texcell zusammen, um Immunreaktionen in Phase 1 klinischen Studien zu studieren.
Virenfreigabe Markt Segmentierung
- Nach Art der Skala der Operation
- Entdeckte Phase
- Präklinische Phase
- Klinische Phase
- Nach Art der Methode der Viral Clearance Testing
- Virenerkennung
- Virale Inaktivierung
- Virenentfernung

Möchten Sie die Möglichkeit erkunden, einzelne Abschnitte dieses Berichts zu kaufen?
Häufig gestellte Fragen :
Was sind die wichtigsten Faktoren, die das Wachstum des Viral Clearance Market behindern?
Die hohen Kosten, die mit viralen Clearance-Tests und strengen regulatorischen Richtlinien und Anforderungen an spezialisierte technische Fähigkeiten und Fachwissen verbunden sind, sind die Hauptfaktoren, die das Wachstum des Viral Clearance Markets behindern.
Was sind die Hauptfaktoren für das Wachstum des Viral Clearance Market?
Die zunehmende Nachfrage nach viralen Clearance-Tests durch den Anstieg der Biologik und Biopharmazeutika und Fortschritte bei viralen Clearance-Technologien wie der Sequenzierung der nächsten Generation sind die wichtigsten Faktoren, die den Viral Clearance Market antreiben.
Welches ist die führende Art der Operation im Viral Clearance Market?
Die führende Art der Skala des Operationssegments ist Klinische Phase.
Welche sind die Hauptakteure im Viral Clearance Market?
Charles River Laboratories, Creative Biolabs, Eurofins Scientific, Microbac Laboratories, MilliporeSigma, Nelson Labs, Syngene International, Texcell, Vironova und WuXi Biologics sind die wichtigsten Spieler.
Was wird das CAGR des Viral Clearance Market sein?
Der CAGR des Viral Clearance Market wird von 2024-2031 auf 10% projiziert.