Генная терапия на рынке офтальмологии АНАЛИЗ РАЗМЕРОВ И ДОЛЕЙ - ТЕНДЕНЦИИ РОСТА И ПРОГНОЗЫ (2024 - 2031)
Генная терапия на рынке офтальмологии сегментируется по показаниям (наследственные заболевания сетчатки, приобретенные заболевания сетчатки), по типу ....
Генная терапия на рынке офтальмологии Тенденции
Рыночный драйвер: рост распространенности генетических заболеваний глаз приводит к увеличению спроса на эффективные методы лечения
Генетические факторы в значительной степени способствуют развитию различных офтальмологических состояний, включая пигментный ретинит, возрастную макулярную дегенерацию (AMD) и глаукому. Исследователи обнаружили, что мутации в 250 генах могут привести только к дегенерации сетчатки. Всемирная распространенность таких наследственных заболеваний сетчатки (IRD) оценивается в диапазоне от 1 до 2000-3000 человек.
Недавние эпидемиологические исследования показывают, что бремя генетических заболеваний глаз постоянно растет в основном из-за увеличения продолжительности жизни во всем мире. Растущие пулы пациентов, сталкивающихся с изнурительной потерей зрения из-за генетических причин, вызвали сильную потребность в новаторских методах лечения. Обычные варианты, такие как медикаментозное лечение и хирургия, неэффективны при остановке прогрессирования заболевания, вызванного генетическими дефектами.
Генная терапия, однако, обещает долгосрочное восстановление или сохранение зрения, точно ориентируясь на основные генетические корни глазных расстройств. Этот потенциал генной терапии для обеспечения лечебного результата с помощью одного введения вызвал значительный интерес со стороны биофармацевтических фирм. Это также способствовало более широкому участию пациентов в текущих клинических испытаниях, оценивающих кандидатную терапию для таких состояний, как врожденный амауроз Лебера и ВМД.
Драйвер рынка - Достижения в технологиях редактирования генов, способствующие развитию новой терапии
За последнее десятилетие революционные технологии для манипулирования генами позволили добиться огромного прогресса в исследованиях генной терапии и разработке продуктов. Среди них CRISPR-Cas9, нуклеазы цинковых пальцев и нуклеазы TALE, которые позволяют быстро и точно редактировать последовательности ДНК. В частности, CRISPR произвел революцию в этой области благодаря своей простоте, универсальности и экономической эффективности. Он ускорил открытие и доклинические исследования, облегчив крупномасштабный скрининг и целевые исследования мутагенеза.
Основываясь на этих платформах, ученые получают более глубокое представление о болезнетворных генных мутациях и сложных молекулярных механизмах, лежащих в основе дегенерации сетчатки. Это привело к созданию нескольких моделей животных, которые имитируют генетические заболевания глаз человека. Такие модели сыграли важную роль в демонстрации доказательства принципа для новых терапевтических стратегий, таких как выбивание дефектных генов, вставка функциональных копий генов и добавление генов посредством доставки вирусных векторов.
В тандеме наличие передовых инструментов характеристики облегчает выбор терапевтических кандидатов с идеальной дозировкой, продолжительностью и свойствами нацеливания на ткани. В совокупности ускоряющиеся темпы технологической эволюции позволяют ученым переводить амбициозные концепции редактирования генов в перспективные терапевтические средства с такими атрибутами, как одноразовое введение и пожизненная эффективность против ранее неизлечимых генетических заболеваний глаз.
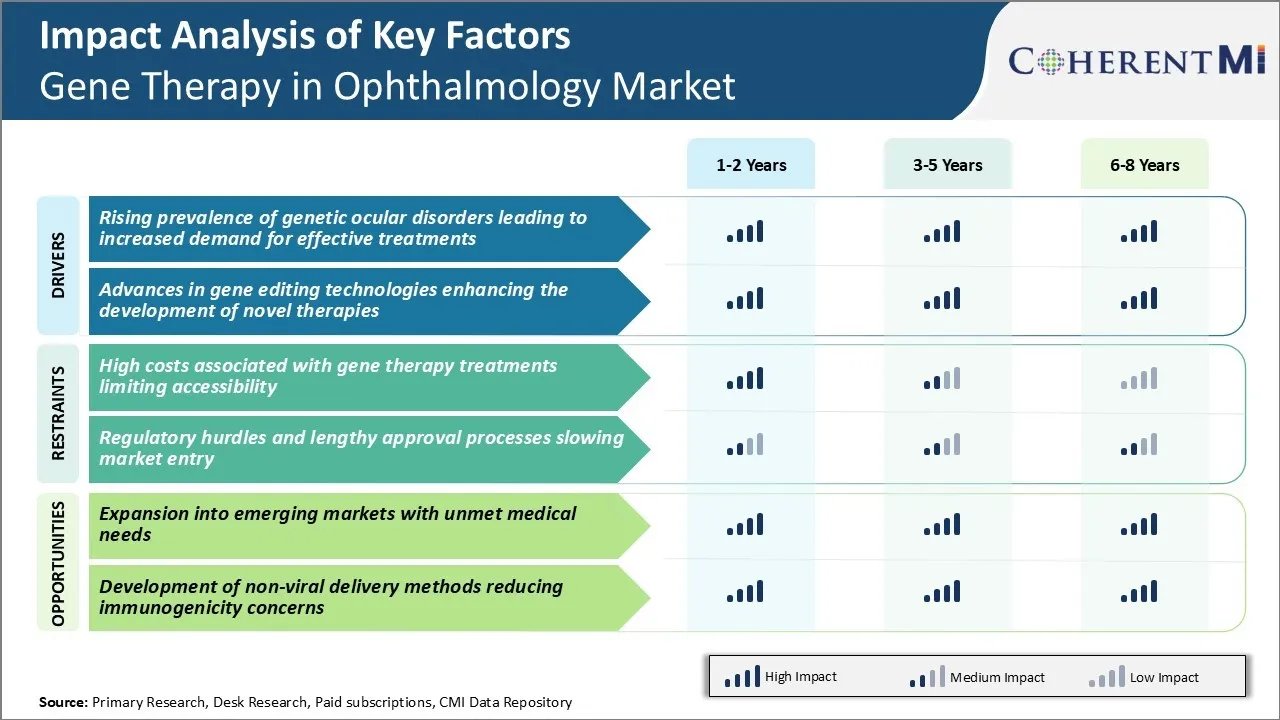
Вызов рынка: высокие затраты, связанные с лечением генной терапией, ограничивающие доступность
Генная терапия различных офтальмологических заболеваний показала огромный потенциал в клинических испытаниях. Однако одной из основных проблем по-прежнему являются высокие затраты, связанные с разработкой и предоставлением таких методов лечения. Разработка эффективной генной терапии обычно требует долгих лет тщательных исследований и тестирования. Этот процесс клинического развития является очень дорогостоящим и рискованным.
Кроме того, производство генной терапии является сложным процессом, который часто включает в себя индивидуальные вирусные векторы и тщательное дозирование для конкретных потребностей каждого пациента. Все эти факторы способствуют высокой цене многих генных терапий, доступных в настоящее время.
Например, вортиген непарвек, первая одобренная генная терапия для наследственного заболевания сетчатки, имеет единовременную цену в 850 000 долларов за лечение. Хотя он показал многообещающие результаты для пациентов, такие высокие затраты ограничивают доступ пациентов и возмещение страховщикам за этот новый подход к лечению.
Поскольку генная терапия для офтальмологических состояний продолжает развиваться, снижение затрат, связанных с развитием и администрированием, будет иметь решающее значение для максимального использования и преимуществ этой технологии в более широких группах пациентов.
Рыночная возможность - расширение на развивающиеся рынки с неудовлетворенными медицинскими потребностями
Одна из значительных возможностей для рынка генной терапии в офтальмологии заключается в расширении на развивающиеся рынки в Азии, Латинской Америке, на Ближнем Востоке и в Африке. Многие группы населения в этих регионах страдают от высокой распространенности ослепляющих офтальмологических заболеваний, но не имеют доступа к передовым вариантам лечения из-за различных экономических и инфраструктурных барьеров.
Генная терапия может трансформировать управление генетически обусловленными расстройствами сетчатки, которые в настоящее время имеют ограниченные возможности лечения на этих рынках. Международные разработчики лекарств и отечественные фармацевтические компании могут извлечь выгоду из этой неудовлетворенной потребности, проводя клинические испытания и нормативные представления, стратегически адаптированные для развивающихся рынков. Партнерство с местными поставщиками медицинских услуг и группами защиты пациентов поможет облегчить идентификацию пациентов и доставку лечения.
Успешная стратегия расширения развивающихся рынков может позволить компаниям, занимающимся генной терапией, получить доступ к более крупным пулам пациентов и значительно увеличить доходы. Это также поможет достичь цели обеспечения доступности таких революционных методов лечения во всем мире.