Cancellazione virale Mercato ANALISI DIMENSIONE E QUOTA - TENDENZE DI CRESCITA E PREVISIONI (2024 - 2031)
Cancellazione virale Il mercato è segmentato da tipo di scala di operazione (Fase di scoperta, Fase preclinica, Fase clinica), da tipo di metodo di te....
Cancellazione virale Mercato Dimensione
Dimensione del mercato in USD Bn
CAGR10%
| Periodo di studio | 2024 - 2031 |
| Anno base della stima | 2023 |
| CAGR | 10% |
| Concentrazione del mercato | Medium |
| Principali attori | Laboratori del fiume Charles, Biolab creative, Eurofins Scientific, Laboratori Microbac, MilliporeSigma e tra gli altri |
faccelo sapere!
Cancellazione virale Mercato Analisi
Il mercato della compensazione virale è stimato in USD 0.9 Bn in 2024 e si prevede di raggiungere USD 1.7 Bn entro il 2031, crescendo ad un tasso di crescita annuale composto (CAGR) del 10% dal 2024 al 2031. Il mercato ha visto una crescita costante negli ultimi anni spinta dalla crescente domanda di sviluppo di biologi e terapeutici sicuri ed efficaci.
Il mercato dovrebbe testimoniare una crescita positiva nel periodo di previsione sostenuto dall'aumento della prevalenza di malattie infettive virali in tutto il mondo e dall'aumento degli investimenti R&D nell'industria biofarmaceutica per lo sviluppo della droga. Inoltre, si prevede che nel corso dei prossimi anni si aggiunga una serie di linee guida regolamentari per quanto riguarda la sicurezza dei biotherapeutics e la crescente adozione di test di autorizzazione virale durante lo sviluppo e la produzione di droga.
Cancellazione virale Mercato Tendenze
Driver per il mercato - Aumentare la domanda di test di compensazione virale a causa del Riso in Biologics e Biofarmaci
La domanda di test di sdoganamento virale ha assistito a una crescita significativa nel corso degli ultimi dieci anni principalmente a causa della crescente produzione e commercializzazione di biologiche complesse e biofarmaci. I biologici come gli anticorpi monoclonali, le proteine ricombinanti, le terapie genetiche e cellulari hanno rivoluzionato il trattamento di diverse malattie croniche e minacciose. Tuttavia, i biologici sono derivati da o prodotti utilizzando cellule viventi e organismi, che li rende altamente sensibili alla contaminazione virale durante la lavorazione a monte e a valle. Anche le tracce di virus possono potenzialmente contaminare grandi lotti, influenzando così la sicurezza del paziente. Considerando le popolazioni vulnerabili dei pazienti mirate da queste terapie salvavita, le aziende farmaceutiche e i regolatori hanno stretto standard di qualità che richiedono test esaustivi a più fasi per rilevare ed eliminare le impurità virali.
Inoltre, la produzione di biologici comporta processi di produzione complessi e multi-step rispetto alle piccole molecole convenzionali. Piattaforme e sistemi di espressione basati su cellule vive sono comunemente utilizzati durante lo sviluppo a monte e la produzione di massa. Ciò aumenta il rischio di introduzione, persistenza o riattivazione dei virus. Inoltre, la produzione biologica si basa frequentemente su cellule e tessuti umani o animali primari, che possono ospitare retrovirus endogeni e altri agenti patogeni. Tutti questi fattori richiedono una vasta caratterizzazione virale, una validazione e uno studio di sdoganamento in tutto il ciclo di vita di sviluppo per assicurare la purezza e la sicurezza del prodotto. Le grandi dimensioni del lotto e le specifiche di rilascio strettamente regolamentate per i biologici implicano che anche un singolo fallimento di produzione può avere significative implicazioni finanziarie per i produttori. Pertanto, i test di sicurezza virali costituiscono una parte cruciale dei rigorosi processi di controllo della qualità stabiliti dalle organizzazioni.
Driver di mercato - Avanzamenti in Viral Clearance Technologies come Sequenziamento di prossima generazione
Il mercato della clearance virale ha assistito a una notevole trasformazione guidata da rapidi progressi nelle tecnologie basate sulla sequenziamento di nuova generazione (NGS). Tradizionalmente, la microscopia PCR e elettron hanno costituito le soluzioni analitiche principali per il rilevamento e l'identificazione virali durante la purificazione e la caratterizzazione del prodotto. Tuttavia, questi approcci hanno una sensibilità limitata per scoprire contaminanti traccia o scoprire nuovi virus. Sono anche incapaci di impronte genomiche complete necessarie per la caratterizzazione virale conclusiva. D'altra parte, il sequenziamento di nuova generazione supera diversi colli di bottiglia di metodi convenzionali attraverso la sua capacità di generare alti volumi di dati di sequenza da metagenomi virali complessi. La preparazione avanzata del campione accoppiata con la lettura di sequenziamento massicciamente parallela consente una screening virale completo con profondità e larghezza senza pari.
I test NGS hanno rivoluzionato le capacità di sdoganamento virale attraverso il multiplexing senza eguali e bassi limiti di rilevamento nella gamma di poche copie virali. Possono testare simultaneamente un ampio pannello di virus noti e scoprire nuovi o varianti patogeni durante l'ottimizzazione del processo, la caratterizzazione e il rilascio del prodotto. Utilizzando dati di sequenza e mappe del genoma virale come impronte digitali, anche virus altamente divergenti o geneticamente modificati possono essere identificati con precisione. Facilita anche l'analisi genomica ad alta risoluzione, il monitoraggio delle tensioni e la sorveglianza delle mutazioni e supporta le indagini dettagliate delle cause radicali in caso di eventuali rilevazioni. Con costi in continuo declino, i flussi di lavoro scalabili NGS stanno sostituendo progressivamente le tecniche tradizionali nei principali hub di produzione biologica. La loro implementazione garantisce una caratterizzazione virale a prova di futuro allineata alle aspettative di settore e normative in rapida evoluzione.
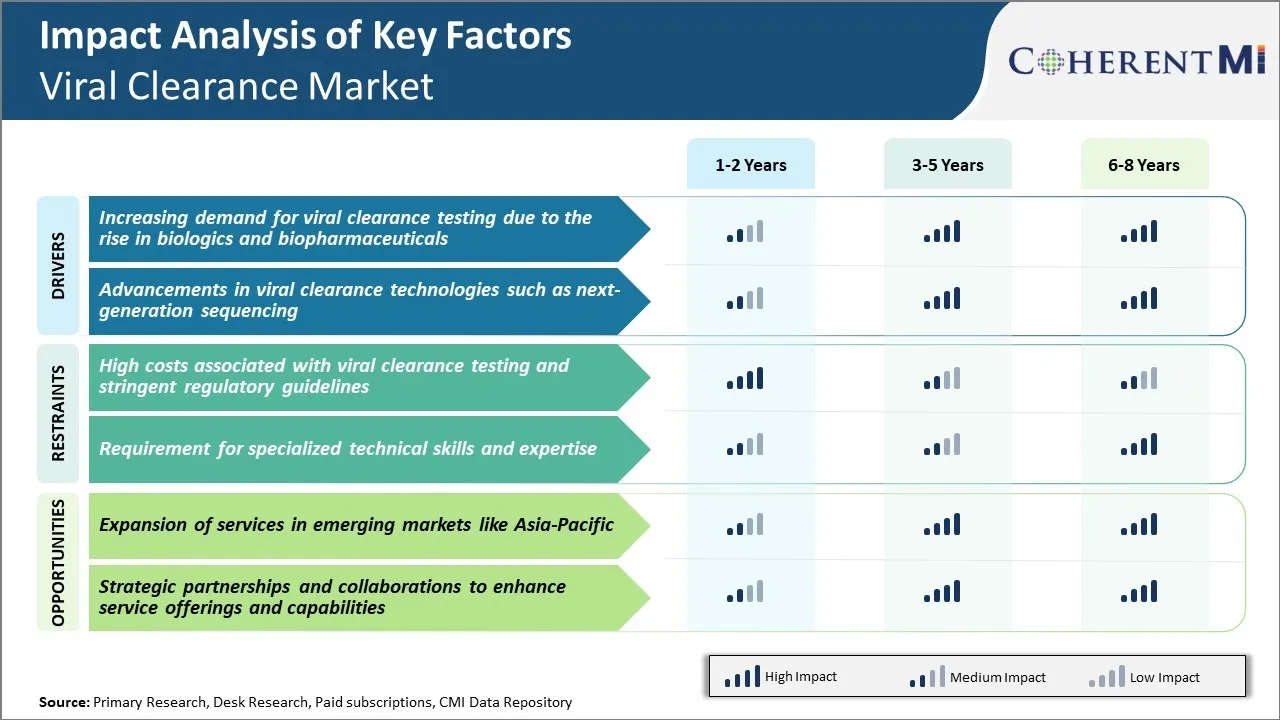
Sfida di mercato - costi elevati associati con test di compensazione virale e linee guida regolatorie stringenti
Il mercato di clearance virale sta affrontando molte sfide a causa degli alti costi associati ai test di clearance virale e delle severe linee guida di regolamentazione. I test di sdoganamento Viral richiedono attrezzature specializzate e impianti di biosicurezza per gestire virus dal vivo, che contribuiscono a costi di capitale e operativi significativamente elevati per le aziende che forniscono questi servizi. Inoltre, il processo di test coinvolge più tecniche analitiche come PCR, ELISA, ecc. per rilevare e rimuovere con precisione i virus, rendendo il processo generale molto costoso. Questo alto costo è infine passato a clienti biofarmaceutici sotto forma di oneri di servizio elevati. Inoltre, severe normative da enti normativi come FDA e EMA hanno reso il processo di approvazione più lungo e più complesso. Le aziende devono presentare dati estesi da studi di validazione virale ben progettati secondo le linee guida ICH per ottenere i loro prodotti approvati. Questa stretta supervisione regolamentare ha aumentato l'onere di conformità per i giocatori di mercato. Con l'aumento degli investimenti R&D delle imprese biofarmaceutiche, i costi di prova hanno un impatto negativo sui loro margini di profitto.
Opportunità di mercato: espansione dei servizi nei mercati emergenti come Asia-Pacifico
C'è una grande opportunità per i fornitori di servizi di clearance virale di espandere i loro servizi nei mercati asiatici emergenti come India, Cina, Corea del Sud e altri. La regione Asia-Pacifico rappresenta uno dei mercati farmaceutici in crescita più rapida a livello globale con l'aumento della produzione biologica da parte delle aziende locali. C'è un notevole outsourcing della bioanalisi e dei test preclinici di sicurezza in Asia da parte di grandi multinazionali bio-companie a causa di costi più bassi. Questo presenta un grande potenziale non sfruttato per le aziende di test di clearance virale. Con la creazione di impianti di prova e la collaborazione con aziende di test locali in questi paesi asiatici, i giocatori di clearance virale globali possono sfruttare i costi operativi più bassi e sfruttare la crescente domanda dei clienti. Diversi governi asiatici stanno anche implementando politiche favorevoli per promuovere la produzione biosimile locale e R&D. Ciò aggiunge alle prospettive di crescita del mercato di clearance virale nella regione Asia-Pacifico.
Panoramica competitiva di Cancellazione virale Mercato
I principali attori del mercato Viral Clearance includono Charles River Laboratories, Creative Biolabs, Eurofins Scientific, Microbac Laboratories, MilliporeSigma, Nelson Labs, Syngene International, Texcell, Vironova e WuXi Biologics.
Cancellazione virale Mercato Leader
- Laboratori del fiume Charles
- Biolab creative
- Eurofins Scientific
- Laboratori Microbac
- MilliporeSigma
Cancellazione virale Mercato - Rivalità competitiva

Cancellazione virale Mercato
(Dominato dai principali attori)
(Altamente competitivo con molti attori.)
Sviluppi recenti in Cancellazione virale Mercato
- Nel giugno 2023, Cytiva e BioCentriq hanno ricevuto 15,8 milioni di dollari da NIIMBL per sviluppare una piattaforma di clearance virale ed esotossina.
- Nel giugno 2023, Texcell aprì un impianto di test in Nord America per migliorare la sicurezza virale dei biotherapeutics.
- Nel giugno 2023, Valo Therapeutics ha collaborato con Texcell per studiare le risposte immunitarie nella fase 1 trial clinico.
Cancellazione virale Mercato Segmentazione
- Per tipo di scala di funzionamento
- Fase di scoperta
- Fase preclinica
- Fase clinica
- Per tipo di metodo di test di compensazione virale
- Detezione virale
- Inattivazione virale
- Rimozione virale

Vorresti esplorare l'opzione di acquistosingole sezioni di questo report?
Domande frequenti :
Quali sono i fattori chiave che ostacolano la crescita del mercato Viral Clearance?
Gli alti costi associati a test di sdoganamento virale e severe linee guida e requisiti normativi per competenze e competenze tecniche specializzate sono i principali fattori che ostacolano la crescita del mercato di compensazione virale.
Quali sono i principali fattori che guidano la crescita del mercato Viral Clearance?
L'aumento della domanda di test di sdoganamento virale a causa dell'aumento di biologici e biofarmaceutici e progressi nelle tecnologie di clearance virale come il sequenziamento di prossima generazione sono i principali fattori che guidano il mercato di compensazione virale.
Qual è il tipo di scala principale di operazione nel mercato di compensazione virale?
Il principale tipo di scala del segmento di operazione è la fase clinica.
Quali sono i principali attori che operano nel Viral Clearance Market?
Charles River Laboratories, Creative Biolabs, Eurofins Scientific, Microbac Laboratories, MilliporeSigma, Nelson Labs, Syngene International, Texcell, Vironova e WuXi Biologics sono i principali attori.
Quale sarà il CAGR del Viral Clearance Market?
Il CAGR del Viral Clearance Market è previsto per il 10% dal 2024-2031.