Limpar Viral Mercado ANÁLISE DE TAMANHO E PARTICIPAÇÃO - TENDÊNCIAS DE CRESCIMENTO E PREVISÕES (2024 - 2031)
Limpar Viral Mercado é Segmentado por tipo de escala de operação (fase de descoberta, fase pré-clínica, fase clínica), por tipo de método de teste de ....
Limpar Viral Mercado Tamanho
Tamanho do mercado em USD Bn
CAGR10%
| Período de estudo | 2024 - 2031 |
| Ano base da estimativa | 2023 |
| CAGR | 10% |
| Concentração de Mercado | Medium |
| Principais jogadores | Laboratórios do Rio Charles, Biolabs Criativos, Eurofins Scientific, Laboratórios de Microbac, Máquina de montagem automática e entre outros |
por favor, avise-nos!
Limpar Viral Mercado Análise
Estima-se que o Viral Clearance Market seja avaliado em USD 0.9 Bn em 2024 e é esperado alcançar USD 1.7 Bn por 2031, crescendo a uma taxa de crescimento anual composta (CAGR) de 10% de 2024 a 2031. O mercado tem visto o crescimento constante ao longo dos últimos anos impulsionado pelo aumento da demanda por desenvolver biológicas e terapêuticas seguras e eficazes.
Espera-se que o mercado testemunhe um crescimento positivo ao longo do período de previsão apoiado pelo aumento da prevalência de doenças infecciosas virais em todo o mundo e o aumento dos investimentos em R&D na indústria biofarmacêutica para o desenvolvimento de drogas. Além disso, são previstas diretrizes regulamentares rigorosas sobre a segurança da bioterapêutica e a adoção crescente de testes de depuração viral durante o desenvolvimento e fabricação de drogas para complementar o crescimento do mercado nos próximos anos.
Limpar Viral Mercado Tendências
Driver de Mercado - Aumentando a demanda por testes de Clearance Viral devido ao Rise em Biologics e Biopharmaceuticals
A demanda por testes de depuração viral tem testemunhado um crescimento significativo ao longo da última década, principalmente devido à crescente produção e comercialização de biológicas complexas e biofarmacêuticas. Biológicas como anticorpos monoclonais, proteínas recombinantes, terapias genéticas e celulares revolucionaram o tratamento de várias doenças crônicas e ameaçadoras de vida. No entanto, os biologics são derivados ou fabricados usando células vivas e organismos, o que os torna altamente suscetíveis à contaminação viral durante o processamento a montante e a jusante. Mesmo a quantidade de vestígios de vírus pode potencialmente contaminar grandes lotes, afetando assim a segurança do paciente. Considerando as populações vulneráveis dos pacientes alvo destas terapias que salvam vidas, as empresas farmacêuticas e os reguladores apertaram os padrões de qualidade que exigem testes exaustivos em várias etapas para detectar e eliminar impurezas virais.
Além disso, a fabricação de biolÃ3gicos envolve processos de produção complexos e multi-passo em comparação com as pequenas moléculas convencionais. Plataformas e sistemas de expressão baseados em células vivas são comumente utilizados durante o desenvolvimento a montante e fabricação a granel. Isso aumenta o risco de introdução, persistência ou reativação de vírus. Além disso, a produção de biolÃ3gica freqüentemente depende de células e tecidos humanos ou animais primários, que podem abrigar retrovírus endógenos e outros patÃ3genos. Todos esses fatores determinam extensos estudos de caracterização viral, validação e depuração ao longo do ciclo de vida de desenvolvimento para garantir a pureza e segurança do produto. Os grandes tamanhos de lotes e as especificações de liberação rigorosamente reguladas para biológicos implicam que mesmo uma única falha de produção pode ter implicações financeiras significativas para os fabricantes. Portanto, o teste de segurança viral constitui uma parte crucial dos rigorosos processos de controle de qualidade estabelecidos pelas organizações.
Driver de mercado - Avanços em Tecnologias de Clearance Viral tais como Sequenciamento de próxima geração
O mercado de desembaraço viral tem testemunhado uma notável transformação impulsionada pelo rápido progresso nas tecnologias baseadas em sequenciamento de próxima geração (NGS). Tradicionalmente, o PCR e a microscopia eletrônica formaram as soluções analíticas para detecção e identificação viral durante a purificação e caracterização do produto. No entanto, essas abordagens têm sensibilidade limitada para descobrir contaminantes de traços ou descobrir vírus novos. Eles também são incapazes de impressão digital genômica completa necessária para caracterização viral conclusiva. Por outro lado, o sequenciamento de nova geração supera vários gargalos de métodos convencionais através de sua capacidade de gerar altos volumes de dados de sequência de metagenomes virais complexos. A preparação avançada da amostra, juntamente com a leitura de sequenciamento massivamente paralela, permite um rastreamento viral abrangente com profundidade e amplitude inigualáveis.
Os ensaios do NGS revolucionaram as capacidades de depuração viral através de multiplexação inigualável e limites de detecção baixos na gama de poucas cópias virais. Eles podem simultaneamente testar para um amplo painel de vírus conhecidos, bem como descobrir novos patógenos ou variantes durante a otimização do processo, caracterização e liberação do produto. Usando dados de sequência e mapas do genoma viral como impressões digitais, até vírus altamente divergentes ou geneticamente modificados podem ser identificados com precisão. Ele também facilita a análise genômica de alta resolução, rastreamento de tensão e vigilância de mutação e suporta investigações de causa raiz detalhadas em caso de qualquer detecção. Com custos de declínio contínuo, os fluxos de trabalho escaláveis do NGS estão substituindo progressivamente técnicas tradicionais nos principais centros de biomanufatura. Sua implementação garante a caracterização viral à prova de futuro, alinhada com a evolução rápida da indústria e as expectativas regulatórias.
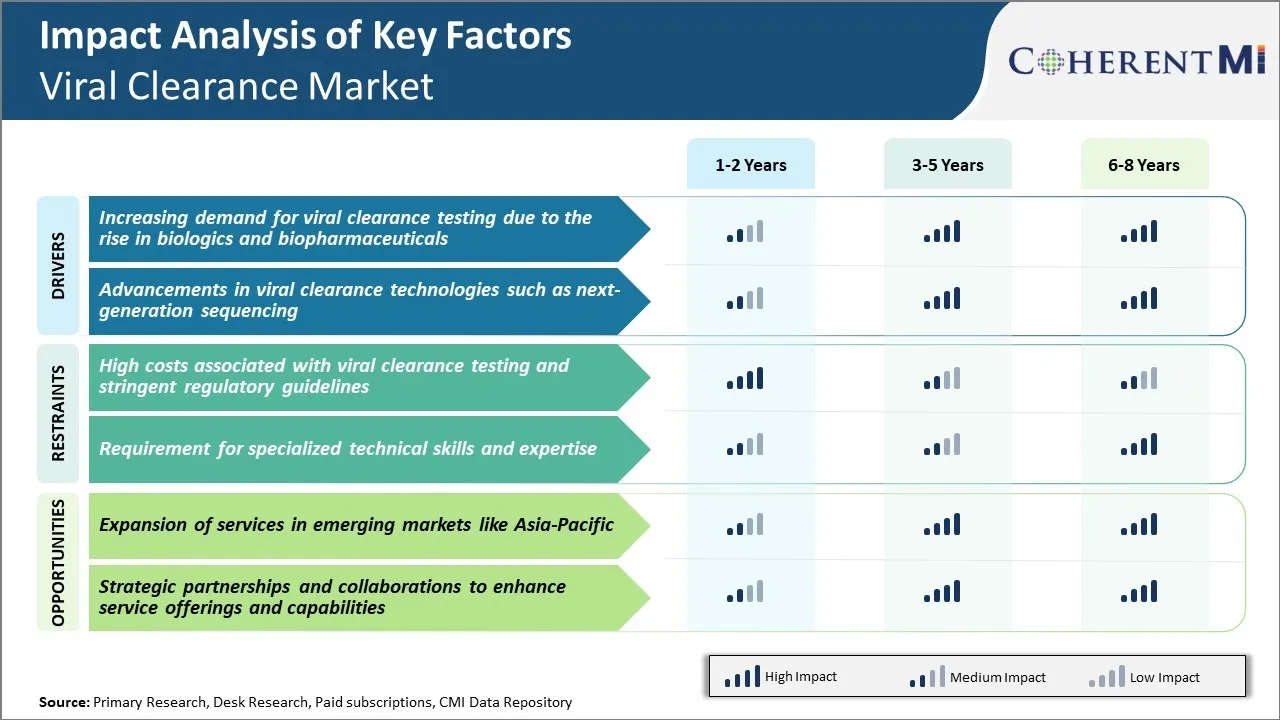
Desafio de Mercado - Altas Custos Associados aos Testes de Clearance Viral e Diretrizes Regulatórias Stringent
O mercado de desembaraço viral está enfrentando muitos desafios devido aos altos custos associados aos testes de depuração viral, bem como diretrizes regulatórias rigorosas. O teste de folga viral requer equipamentos especializados e instalações de biossegurança para lidar com vírus ao vivo, o que contribui para custos operacionais e de capital significativamente elevados para as empresas que prestam esses serviços. Além disso, o processo de teste envolve várias técnicas analíticas como PCR, ELISA, etc para detectar e remover vírus com precisão, tornando o processo geral muito caro. Este alto custo é finalmente passado para clientes biofarmacêuticos na forma de altas taxas de serviço. Além disso, regulamentos rigorosos de órgãos reguladores como FDA e EMA tornaram o processo de aprovação mais longo e mais complexo. As empresas precisam apresentar extensos dados de estudos de validação viral bem desenhados conforme as diretrizes do ICH para obter seus produtos aprovados. Esta rigorosa supervisão regulatória tem aumentado a carga de conformidade para os jogadores de mercado. Com o aumento dos investimentos em R&D de empresas biofarmacêuticas, os custos de teste estão impactando negativamente suas margens de lucro.
Oportunidade de mercado: Expansão de serviços em mercados emergentes como Ásia-Pacífico
Há uma grande oportunidade para os prestadores de serviços de depuração viral expandir seus serviços em mercados asiáticos emergentes como a Índia, China, Coreia do Sul e outros. A região Ásia-Pacífico representa um dos mercados farmacêuticos mais rápidos em crescimento global com o aumento da produção biológica por empresas locais. Há uma terceirização significativa da bioanálise e testes de segurança pré-clínica para a Ásia por grandes biocompanias multinacionais devido a custos mais baixos. Isso apresenta um grande potencial inexplorado para empresas de testes de depuração viral. Ao configurar instalações de teste e fazer parceria com empresas de testes locais nesses países asiáticos, os jogadores globais de folga viral podem alavancar custos operacionais mais baixos e acessar a crescente demanda do cliente. Vários governos asiáticos também estão implementando políticas favoráveis para promover a produção local de biosimilar e R&D. Isso acrescenta às perspectivas de crescimento do mercado de desembaraço viral na região Ásia-Pacífico.
Visão geral competitiva de Limpar Viral Mercado
Os principais jogadores que operam no Mercado de Clearance Viral incluem Charles River Laboratories, Creative Biolabs, Eurofins Scientific, Microbac Laboratories, MilliporeSigma, Nelson Labs, Syngene International, Texcell, Vironova e WuXi Biologics.
Limpar Viral Mercado Líderes
- Laboratórios do Rio Charles
- Biolabs Criativos
- Eurofins Scientific
- Laboratórios de Microbac
- Máquina de montagem automática
Limpar Viral Mercado - Rivalidade Competitiva

Limpar Viral Mercado
(Dominado por grandes players)
(Altamente competitivo com muitos jogadores.)
Desenvolvimentos recentes em Limpar Viral Mercado
- Em junho de 2023, Cytiva e BioCentriq receberam US$ 15,8 milhões da NIIMBL para desenvolver uma plataforma de desembaraço viral e exotoxina.
- Em junho de 2023, Texcell abriu uma instalação de testes na América do Norte para melhorar a segurança viral da bioterapêutica.
- Em junho de 2023, Valo Therapeutics fez parceria com a Texcell para estudar respostas imunes no ensaio clínico da Fase 1.
Limpar Viral Mercado Segmentação
- Por tipo de escala de operação
- Fase de descoberta
- Fase pré-linical
- Fase clínica
- Por tipo de método de teste de Clearance Viral
- Detecção Viral
- Inativação viral
- Remoção viral

Gostaria de explorar a opção de comprasecções individuais deste relatório?
Perguntas Frequentes :
Quais são os principais fatores que dificultam o crescimento do Mercado de Clearance Viral?
Os altos custos associados com testes de depuração viral e diretrizes regulatórias rigorosas e a exigência de habilidades e conhecimentos técnicos especializados são os principais fatores que dificultam o crescimento do Mercado de Clearance Viral.
Quais são os principais fatores que impulsionam o crescimento do Viral Clearance Market?
A crescente demanda por testes de depuração viral devido ao aumento de biológicos e biofarmacêuticos e avanços em tecnologias de depuração viral, como sequenciamento de próxima geração, são os principais fatores que impulsionam o Mercado de Clearance Viral.
Qual é o tipo líder de escala de operação no mercado de Clearance Viral?
O tipo líder do segmento de escala de operação é a fase clínica.
Quais são os principais jogadores que operam no Viral Clearance Market?
Charles River Laboratories, Creative Biolabs, Eurofins Scientific, Microbac Laboratories, MilliporeSigma, Nelson Labs, Syngene International, Texcell, Vironova e WuXi Biologics são os principais jogadores.
Qual será o CAGR do Mercado de Clearance Viral?
O CAGR do Mercado Viral Clearance é projetado para ser 10% de 2024-2031.