Liquidation virale Marché ANALYSE DE LA TAILLE ET DU PARTAGE - TENDANCES DE CROISSANCE ET PRÉVISIONS (2024 - 2031)
Liquidation virale Le marché est segmenté par type d'échelle d'opération (phase découverte, phase préclinique, phase clinique), par type de méthode d'....
Liquidation virale Marché Taille
Taille du marché en USD Bn
TCAC10%
| Période d'étude | 2024 - 2031 |
| Année de base de l'estimation | 2023 |
| TCAC | 10% |
| Concentration du marché | Medium |
| Principaux acteurs | Laboratoires Charles River, Biolabs créatifs, Eurofins scientifique, Laboratoires de microbac, MilliporeSigma et parmi d'autres |
Merci de nous le faire savoir !
Liquidation virale Marché Analyse
Le marché de l'autorisation virale est estimé à USD 0,9 Bn en 2024 et devrait atteindre 1,7 milliard USD par 2031, en croissance à un taux de croissance annuel composé (CAGR) de 10 % de 2024 à 2031. Au cours des dernières années, le marché a connu une croissance soutenue grâce à la demande croissante de produits biologiques et thérapeutiques sûrs et efficaces.
Le marché devrait connaître une croissance positive au cours de la période de prévision soutenue par l'augmentation de la prévalence des maladies infectieuses virales dans le monde et l'augmentation des investissements en R-D dans l'industrie biopharmaceutique pour la mise au point de médicaments. De plus, des lignes directrices réglementaires rigoureuses concernant l'innocuité des produits biothérapeutiques et l'adoption croissante de tests de clairance virale pendant la mise au point et la fabrication des médicaments devraient compléter la croissance du marché au cours des prochaines années.
Liquidation virale Marché Tendances
Inducteur du marché - Demande croissante de tests d'élimination virale en raison de l'augmentation des produits biologiques et biopharmaceutiques
La demande de tests de clairance virale a connu une croissance importante au cours de la dernière décennie, principalement en raison de la production et de la commercialisation accrues de produits biologiques complexes et de produits biopharmaceutiques. Des produits biologiques comme les anticorps monoclonaux, les protéines recombinantes, les thérapies génétiques et cellulaires ont révolutionné le traitement de plusieurs maladies chroniques et mortelles. Toutefois, les produits biologiques sont dérivés ou fabriqués à partir de cellules et d'organismes vivants, ce qui les rend très sensibles à la contamination virale pendant le traitement en amont et en aval. Même des traces de virus peuvent potentiellement contaminer de grands lots, ce qui affecte la sécurité du patient. Compte tenu des populations de patients vulnérables ciblées par ces thérapies vitales, les entreprises pharmaceutiques et les organismes de réglementation ont renforcé les normes de qualité exigeant des tests exhaustifs à plusieurs stades pour détecter et éliminer les impuretés virales.
De plus, la fabrication de produits biologiques comporte des processus de production complexes en plusieurs étapes par rapport aux médicaments classiques à petites molécules. Les plates-formes et les systèmes d'expression à base de cellules vivantes sont couramment utilisés pendant le développement en amont et la fabrication en vrac. Cela augmente le risque d'introduction, de persistance ou de réactivation des virus. De plus, la production biologique repose souvent sur des cellules et tissus humains ou animaux primaires, qui peuvent contenir des rétrovirus endogènes et d'autres agents pathogènes. Tous ces facteurs exigent de vastes études de caractérisation, de validation et de clairance virales tout au long du cycle de développement pour assurer la pureté et l'innocuité du produit. Les grandes tailles de lots et les spécifications de libération strictement réglementées pour les produits biologiques impliquent que même une défaillance d'un seul cycle de production peut avoir des incidences financières importantes pour les fabricants. Par conséquent, le dépistage de l'innocuité virale fait partie intégrante des processus rigoureux de contrôle de la qualité établis par les organisations.
Pilote du marché - Progrès dans les technologies de dédouanement viral telles que le séquençage de la prochaine génération
Le marché de la clairance virale a connu une transformation remarquable grâce à des progrès rapides dans les technologies basées sur le séquençage de la prochaine génération. Traditionnellement, la microscopie PCR et électronique formait les solutions analytiques principales pour la détection et l'identification virales pendant la purification et la caractérisation du produit. Cependant, ces approches ont une sensibilité limitée à la découverte de contaminants traces ou à la découverte de virus nouveaux. Ils sont également incapables d'avoir une empreinte génomique complète requise pour une caractérisation virale concluante. D'autre part, le séquençage de la nouvelle génération permet de surmonter plusieurs goulots d'étranglement des méthodes conventionnelles grâce à sa capacité à produire des volumes élevés de données de séquence à partir de métagénomes viraux complexes. La préparation avancée d'échantillons couplée à une lecture massivement parallèle du séquençage permet un dépistage viral complet avec une profondeur et une largeur inégalées.
Les tests NGS ont révolutionné les capacités de clairance virale grâce à un multiplexage inégalé et à de faibles limites de détection dans la gamme de quelques copies virales. Ils peuvent simultanément tester un large panel de virus connus ainsi que découvrir des pathogènes nouveaux ou variables pendant l'optimisation du processus, la caractérisation et la libération du produit. À l'aide de données de séquence et de cartes du génome viral comme empreintes digitales, même des virus très divergents ou génétiquement modifiés peuvent être identifiés avec précision. Il facilite également l'analyse génomique à haute résolution, le suivi des souches et la surveillance des mutations et soutient des enquêtes détaillées sur les causes profondes en cas de détection. Avec une baisse continue des coûts, les flux de travail évolutifs des NGS remplacent progressivement les techniques traditionnelles dans les grands centres de production biologique. Leur mise en oeuvre assure une caractérisation virale à l'épreuve de l'avenir, conforme aux attentes en évolution rapide de l'industrie et de la réglementation.
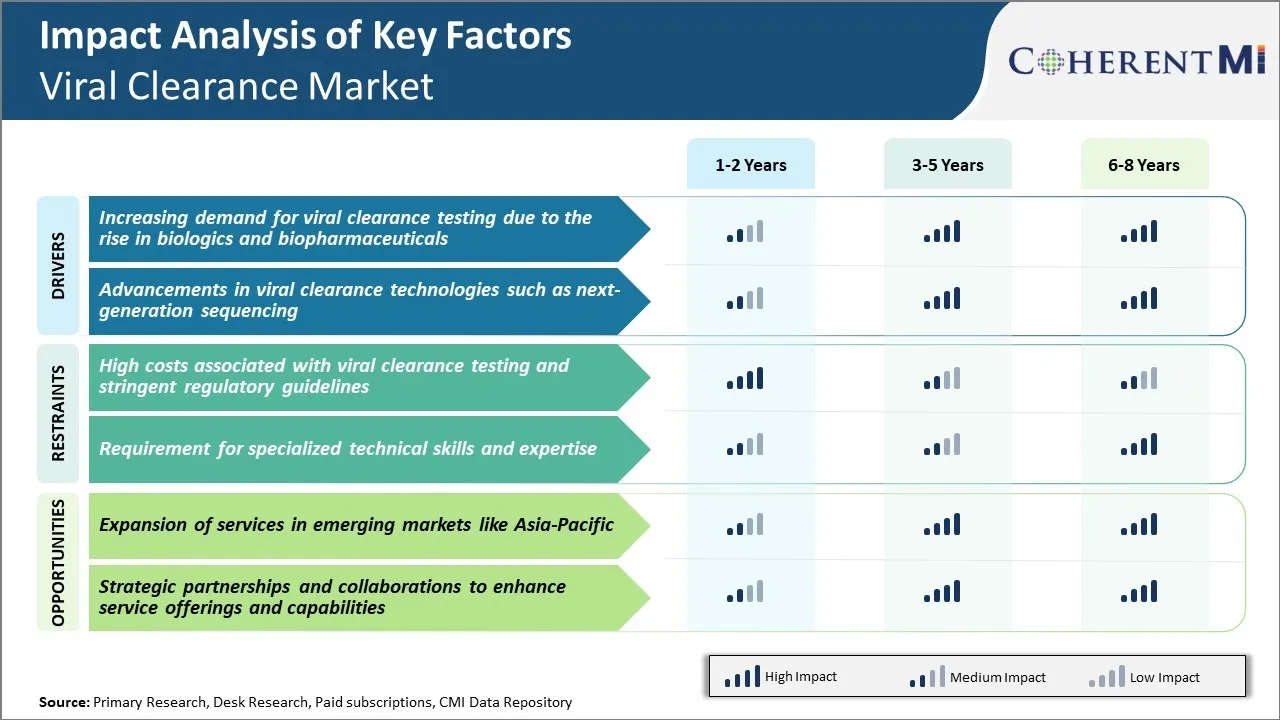
Défi du marché - Coûts élevés associés aux tests d'élimination virale et aux lignes directrices réglementaires sur les chaînes
Le marché de la clairance virale est confronté à de nombreux défis en raison des coûts élevés associés aux tests de clairance virale ainsi que des lignes directrices réglementaires rigoureuses. Les tests de dépollution virale nécessitent du matériel spécialisé et des installations de biosécurité pour traiter les virus vivants, ce qui contribue à des coûts d'investissement et d'exploitation considérables pour les entreprises qui fournissent ces services. De plus, le processus d'essai implique plusieurs techniques analytiques comme PCR, ELISA, etc. pour détecter et éliminer les virus avec précision, rendant le processus global très coûteux. Ce coût élevé est finalement répercuté sur les clients biopharmaceutiques sous forme de frais de service élevés. De plus, des règlements rigoureux de la part d'organismes de réglementation comme la FDA et l'EMA ont rendu le processus d'approbation plus long et plus complexe. Les entreprises doivent présenter des données exhaustives provenant d'études de validation virale bien conçues, conformément aux lignes directrices de l'ICH, pour obtenir l'approbation de leurs produits. Cette surveillance réglementaire rigoureuse a alourdi le fardeau de conformité pour les acteurs du marché. Avec l'augmentation des investissements en R-D des entreprises biopharmaceutiques, les coûts d'analyse ont une incidence négative sur leurs marges bénéficiaires.
Opportunité de marché : expansion des services dans les marchés émergents comme l'Asie-Pacifique
Il existe une occasion importante pour les fournisseurs de services de dépollution virale d'étendre leurs services sur les marchés asiatiques émergents comme l'Inde, la Chine, la Corée du Sud et d'autres. La région Asie-Pacifique représente l'un des marchés pharmaceutiques qui connaissent la croissance la plus rapide à l'échelle mondiale, avec une production accrue de produits biologiques par les entreprises locales. Il y a une importante sous-traitance de la bioanalyse et des tests de sécurité précliniques vers l'Asie par les grandes entreprises multinationales en raison des coûts réduits. Cela présente un fort potentiel inexploité pour les entreprises de dépistage de la clairance virale. En mettant en place des installations d'essai et en s'associant à des entreprises locales d'essais dans ces pays asiatiques, les acteurs mondiaux du déminage viral peuvent tirer parti d'une réduction des coûts d'exploitation et tirer parti de la demande croissante des clients. Plusieurs gouvernements asiatiques mettent également en oeuvre des politiques favorables pour promouvoir la production biosimilaire locale et la R-D. Cela ajoute aux perspectives de croissance du marché de la clairance virale dans la région Asie-Pacifique.
Aperçu concurrentiel de Liquidation virale Marché
Les principaux acteurs du marché de la clairance virale sont Charles River Laboratories, Creative Biolabs, Eurofins Scientific, Microbac Laboratories, MilliporeSigma, Nelson Labs, Syngene International, Texcell, Vironova et WuXi Biologics.
Liquidation virale Marché Leaders
- Laboratoires Charles River
- Biolabs créatifs
- Eurofins scientifique
- Laboratoires de microbac
- MilliporeSigma
Liquidation virale Marché - Rivalité concurrentielle

Liquidation virale Marché
(Dominé par des acteurs majeurs)
(Très compétitif avec de nombreux acteurs.)
Développements récents dans Liquidation virale Marché
- En juin 2023, Cytiva et BioCentriq ont reçu 15,8 millions de dollars de NIIMBL pour développer une plateforme de clairance virale et d'exotoxine.
- En juin 2023, Texcell a ouvert une installation d'essai en Amérique du Nord pour améliorer la sécurité virale des biothérapeutiques.
- En juin 2023, Valo Therapeutics s'est associé à Texcell pour étudier les réponses immunitaires dans l'essai clinique de phase 1.
Liquidation virale Marché Segmentation
- Par type d'échelle de fonctionnement
- Phase de découverte
- Phase préclinique
- Phase clinique
- Par type de méthode d'essai d'élimination virale
- Détection virale
- Inactivation virale
- Suppression virale

Souhaitez-vous explorer l'option d'achat sections individuelles de ce rapport ?
Questions fréquemment posées :
Quels sont les principaux facteurs qui entravent la croissance du marché de la compensation virale?
Les coûts élevés associés aux tests de clairance virale et à des lignes directrices réglementaires rigoureuses ainsi qu'à l'exigence de compétences techniques et d'expertise spécialisées sont les principaux facteurs qui entravent la croissance du marché de la clairance virale.
Quels sont les principaux facteurs à l'origine de la croissance du marché du dédouanement viral?
La demande croissante de tests de clairance virale en raison de l'augmentation des produits biologiques et biopharmaceutiques et des progrès dans les technologies de clairance virale telles que le séquençage de la prochaine génération sont les principaux facteurs à l'origine du marché de la clairance virale.
Quel est le principal type d'échelle d'exploitation sur le marché de la compensation virale?
Le premier segment de type d'échelle d'opération est la phase clinique.
Quels sont les principaux acteurs du marché de la compensation virale?
Charles River Laboratories, Creative Biolabs, Eurofins Scientific, Microbac Laboratories, MilliporeSigma, Nelson Labs, Syngene International, Texcell, Vironova et WuXi Biologics sont les principaux acteurs.
Quel sera le TCAC du marché de l'autorisation virale?
Le TCAC du marché de la compensation virale devrait être de 10 % entre 2024 et 2031.