Рынок нейроэндокринных опухолей АНАЛИЗ РАЗМЕРОВ И ДОЛЕЙ - ТЕНДЕНЦИИ РОСТА И ПРОГНОЗЫ (2024 - 2031)
Рынок нейроэндокринных опухолей сегментируется по фазе клинического развития (продукты поздней стадии (фаза III), продукты средней стадии (фаза II), п....
Рынок нейроэндокринных опухолей Размер
Размер рынка в долларах США Bn
CAGR6.2%
| Период исследования | 2024 - 2031 |
| Базовый год оценки | 2023 |
| CAGR | 6.2% |
| Концентрация рынка | High |
| Основные игроки | RayzeBio, Inc., Сенека Терапевтика, Vyriad, Inc., ADC терапия, Neotropix, Inc. и среди других |
дайте нам знать!
Рынок нейроэндокринных опухолей Анализ
Мировой рынок нейроэндокринных опухолей оценивается как 4,8 млрд долларов в 2024 году Ожидается, что он достигнет 7,3 млрд долларов к 2031 году, растущие с совокупным годовым темпом роста (CAGR) 6,2% с 2024 по 2031 год. Достижения в области диагностических методов и разработки новых целевых и комбинированных методов лечения способствуют росту рынка. Рынок наблюдает положительные тенденции с ростом распространенности нейроэндокринных опухолей во всем мире. Кроме того, ожидается, что расширение исследовательской деятельности по разработке биомаркеров, адресной доставке лекарств и разработке схем комбинированной терапии для лечения предоставит выгодные возможности для игроков рынка в течение прогнозируемого периода.
Рынок нейроэндокринных опухолей Тенденции
Драйвер рынка - Достижения в целевой терапии нейроэндокринных опухолей.
С постоянными достижениями в понимании биологии и патогенеза нейроэндокринных опухолей таргетная терапия показала многообещающие результаты. В последние годы было выявлено несколько молекулярных мишеней, которые не регулируются в NET. Препараты, нацеленные на эти молекулярные изменения, продемонстрировали клиническую пользу с более приемлемыми профилями безопасности по сравнению с обычной химиотерапией. Аналоги соматостатина, такие как октреотид и ланреотид, установили роль в контроле симптомов из функциональных NET и ограничении роста опухоли. В настоящее время доступны новые лиганды рецепторов соматостатина с более благоприятной фармакокинетикой, которые потенциально могут улучшить результаты лечения пациентов. Препараты, нацеленные на рецепторы тирозинкиназы, участвующие в путях роста опухоли, также показали преимущества. Сунитиниб и эверолимус были одобрены для лечения поджелудочной железы на основе крупных клинических испытаний, демонстрирующих улучшение выживаемости без прогрессирования. Эверолимус дополнительно одобрен для лечения нефункциональных желудочно-кишечных и легочных NETs. Другие целевые препараты, ингибирующие ключевые сигнальные молекулы, продолжают изучаться в ходе текущих клинических испытаний. Комбинирование различных целевых агентов или их сочетание с химиотерапией также многообещающе. При более глубоком механистическом понимании факторов заболевания и улучшении методов разработки лекарств, доступность эффективных целевых методов лечения, адаптированных к молекулярным изменениям в отдельных опухолях, вероятно, значительно расширится. Это приведет к большему количеству вариантов лечения, связанных с лучшей переносимостью и качеством жизни пациентов.
Повышение осведомленности и ранняя диагностика приводят к огромному спросу на диагностику.
Диагностика нейроэндокринных опухолей на ранней стадии, когда заболевание локализовано, может существенно повысить эффективность лечения и прогноз. Однако из-за неспецифического характера симптомов, связанных с NET, и отсутствия рекомендаций по скринингу многие пациенты часто диагностируются на поздней стадии, когда опухоль уже метастазировала. Это создает проблемы для управления и снижает эффективность лечения. Инициативы, направленные на информирование как пациентов, так и медицинских работников о признаках и симптомах NET, помогли повысить осведомленность в последнее время. Повышенная осведомленность позволяет людям распознавать потенциальные симптомы и быстро обращаться за медицинской помощью. Это также делает врачей более осведомленными, чтобы включить NET в свои дифференциальные диагнозы. Кроме того, достижения в области методов диагностической визуализации и идентификации циркулирующих биомаркеров расширили возможности раннего обнаружения. В сочетании с высоким показателем клинической подозрительности эти диагностические инструменты облегчают выявление небольших опухолей или обнаружение метастазов раньше, чем раньше, у бессимптомных пациентов. Обучение групп риска и внедрение стандартизированных протоколов скрининга может потенциально увеличить раннее выявление случаев заболевания. По мере того, как диагностика на ранних стадиях становится все более распространенной из-за повышения осведомленности и точности диагностики, она, вероятно, улучшит статистику выживаемости и результаты лечения для пациентов с NET в ближайшие годы.

Вызов рынка - высокая стоимость, связанная с целевым лечением.
Стоимость таргетной терапии нейроэндокринных опухолей представляет собой серьезную проблему для рынка. Многие из новых высокоточных лекарств для нейроэндокринных опухолей требуют генетического или биомаркерного тестирования для выявления подходящих пациентов. Тем не менее, эта сопутствующая диагностика добавляет значительные затраты на общее лечение и лечение заболевания. Сами целевые препараты также имеют очень высокие цены, некоторые из них стоят более 100 000 долларов США в год лечения. Такой уровень расходов просто невозможен для многих государственных и частных систем здравоохранения во всем мире. Высокие затраты ограничивают доступ к этим важным целевым вариантам и их возмещение. Пациенты и их семьи также борются с экономическим бременем, поскольку расходы из собственных средств продолжают расти с каждым годом. Общие расходы на здравоохранение могут резко возрасти, если стратегии сдерживания затрат не будут приняты. Фармацевтические компании должны будут использовать ценовые модели и развивать партнерские отношения с плательщиками медицинских услуг, чтобы сделать точные лекарства для нейроэндокринных опухолей более доступными и устойчивыми в долгосрочной перспективе.
Возможности рынка: разработка новых методов лечения онколитических вирусов.
Развитие онколитической вирусной терапии предоставляет значительные возможности для продвижения на рынке нейроэндокринных опухолей. Онколитические вирусы являются естественными или биоинженерными вирусами, которые могут избирательно заражать и убивать раковые клетки, избегая при этом нормальной ткани. Несколько типов онколитического вируса находятся под следствием для лечения нейроэндокринных опухолей, включая аденовирусы, вирусы герпеса и вирусы вакцинии. Эти новые методы биотерапии могут помочь удовлетворить неудовлетворенные потребности, предлагая точное уничтожение раковых клеток с целенаправленной доставкой и минимальными побочными эффектами. Текущие клинические исследования изучают онколитические вирусные терапии как отдельно, так и в сочетании с ингибиторами контрольных точек или другими агентами. В случае успеха онколитические вирусы могут трансформировать стандарты лечения, предоставляя новые варианты обслуживания или консолидации после начальной терапии, а также лечения тугоплавких заболеваний. Этот новый подход обещает стать прецизионным лекарством следующего поколения для нейроэндокринных опухолей с потенциально благоприятным побочным эффектом и профилем затрат по сравнению с традиционными вариантами.
Предпочтения врачей Рынок нейроэндокринных опухолей
Нейроэндокринные опухоли (NETs) обычно лечатся на основе стадии заболевания. Для ранних стадий (стадия I-II) неметастатических NET, аналоги соматостатина, такие как октреотид (сандостатин) и ланреотид (соматулин), обычно назначаются для контроля симптомов. Для более продвинутых локально инвазивных опухолей может использоваться чрескожная абляция или трансартериальная эмболизация.
На стадии III-IV метастатических NET аналоги соматостатина продолжают оставаться вариантом первой линии для контроля секреции гормонов и снижения роста опухоли. Пациентам также может быть назначен Эверолимус (Афинитор) или Сунитиниб (Сутент), поскольку эти ингибиторы мультикиназы показали эффективность против прогрессирования NET. Для агрессивно растущих или высокосортных опухолей некоторые врачи предпочитают химиотерапию с использованием Темозоломида (Temodar) или Капецитабина (Xeloda), поскольку эти агенты проявляют большие цитотоксические эффекты по сравнению с таргетной терапией.
Для пациентов с рефрактерными заболеваниями, которые прогрессируют в лечении первой линии, врачи могут затем рассмотреть клинические испытания, в которых тестируются новые агенты, такие как Lu-177-Dotatate (Lutathera), препарат с радиомаркированным соматостатиновым рецептором. Такие факторы, как состояние работоспособности, вовлеченность органов и генетические мутации, также направляют прописавших к конкретным вариантам второй или третьей линии, где это возможно. Агрессивное лечение заболеваний с помощью междисциплинарного командного подхода помогает максимизировать результаты.
Анализ вариантов лечения Рынок нейроэндокринных опухолей
Нейроэндокринные опухоли инсценируются в зависимости от размера и распространения опухоли. Для локализованного заболевания (стадия I/II) хирургическое вмешательство является первичным лечением с целью полного удаления опухоли. Для пациентов, у которых не удается удалить всю опухоль (стадия III/IV), применяют системную терапию.
Системное лечение первой линии обычно представляет собой аналоги соматостатина (SSA), такие как октреотид или ланреотид. SSA работают, ограничивая производство гормонов, секретируемых опухолью. Они предпочтительны изначально из-за их легкого профиля побочных эффектов по сравнению с другими вариантами. Для пациентов, которые прогрессируют на или после шести месяцев ССА, выбор терапии второй линии зависит от характеристик заболевания и симптомов.
Хорошо дифференцированные опухоли, которые все еще являются локально-продвинутыми, обрабатываются радионуклидной терапией пептидных рецепторов с использованием меток, таких как лютеций-177 или иттрий-90, присоединенных к октреотиду или ланреотиду. Это нацелено на доставку радиоактивных молекул непосредственно в опухолевые клетки. Для метастатического или высококачественного заболевания часто используется химиотерапевтический препарат сунитиниб. Он работает путем ингибирования ангиогенеза опухоли и, как правило, хорошо переносится при прерывистом графике двух недель или четырех недель лечения. Более новые целевые методы лечения, такие как эверолимус и радиомаркированные аналоги соматостатина, также показали многообещающие результаты клинических испытаний.
Многодисциплинарный подход к лечению и секвенирование вариантов на основе стадии заболевания и ответа позволяет улучшить результаты у пациентов с нейроэндокринной опухолью. Персонализированный выбор терапии помогает максимизировать контроль симптомов и выживаемость.
Ключевые выигрышные стратегии, принятые ключевыми игроками Рынок нейроэндокринных опухолей
Сосредоточьтесь на НИОКР и разработке лекарств: Крупные игроки вложили значительные средства в исследования и разработки для разработки новых и целевых вариантов лечения для NET. Novartis инвестировала более 8,99 млрд долларов США в исследования и разработки в 2020 году, что привело к одобрению Lutathera, первой одобренной США радионуклидной терапии пептидных рецепторов для NET.
Целевые приобретения: Компании расширили свои продуктовые портфели и клинические трубопроводы за счет стратегических приобретений. Например, в 2019 году Ipsen приобрела Clementia Pharmaceuticals в основном для паловаротена, агониста RARγ в клинических испытаниях для прогрессирования фибродисплазии осцификанов и множественных остеохондром. Это укрепило их портфель редких заболеваний.
Расширение в смежные терапевтические области: Многие игроки изучают варианты лечения NET на разных стадиях заболевания. Например, в 2021 году Bayer запустила испытание фазы 3 ингибитора VEGF Nexavar в сочетании с сунитинибом для продвинутых/метастатических панкреатических NET. Это позволяет им ориентироваться на более широкую базу пациентов на разных этапах лечения.
Сегментарный анализ Рынок нейроэндокринных опухолей
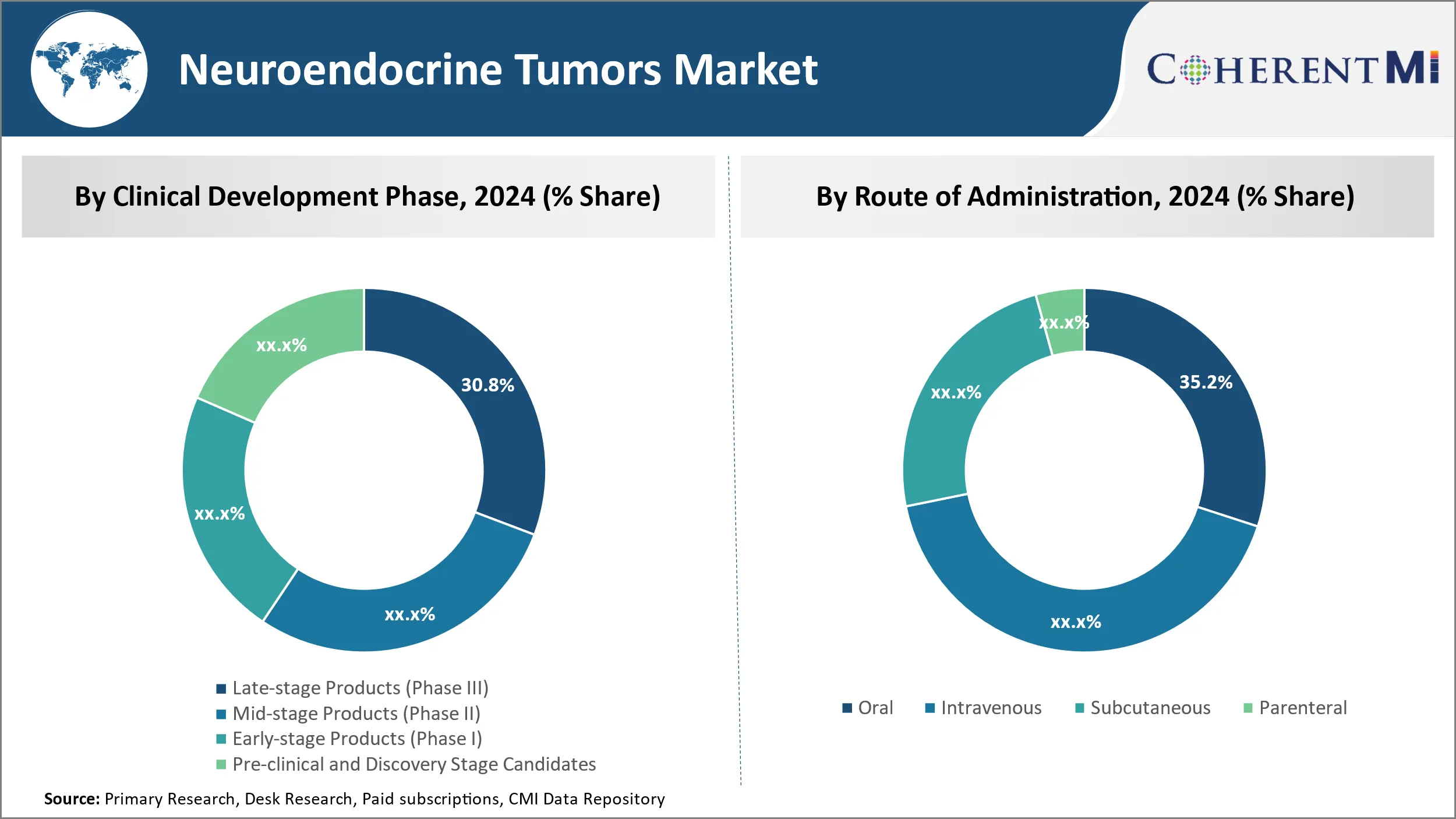
Инсайт, по фазе клинического развития: > Продукты поздней стадии (фаза III) Насладиться замечательной позицией в ближайшие годы из-за таргетинга основных вех.
Ожидается, что к фазе клинического развития продукты поздней стадии (фаза III) внесут наибольшую долю в 30,8% в 2024 году из-за их способности ориентироваться на основные клинические этапы. Продукты III фазы уже показали безопасность и эффективность в небольших испытаниях и тестируются на больших группах пациентов, чтобы подтвердить эти результаты. Успешное испытание III фазы приводит к утверждению регулирующих органов и коммерческому запуску, позволяя продуктам получать доход от продаж. Таким образом, компании вкладывают значительные средства в Фазу III, поскольку она представляет собой последний шаг, прежде чем продукты смогут выйти на полный коммерческий рынок. Большие группы пациентов предоставляют существенные данные для целевых показателей по регионам, в то время как активы на ранних этапах все еще должны доказывать концепции. Кроме того, результаты испытаний оказывают большее влияние на оценку и интерес к сотрудничеству со стороны других фирм. Учитывая эти факторы, продукты, нацеленные на неизбежное доказательство эффективности и запуск, внушают наибольшую уверенность, стимулируя большие инвестиции и поглощение продуктов поздней стадии по сравнению с другими клиническими фазами.
По пути администрирования, устный сегмент, как ожидается, будет расти за счет оптимизации вариантов администрирования.
Ожидается, что в 2024 году устный перевод обеспечит самую высокую долю рынка в 35,2% благодаря оптимальному удобству. В отличие от внутривенных и парентеральных форм, требующих специализированного введения с помощью игл или инфузий, пероральные препараты могут быть самостоятельно введены с помощью простого приема внутрь, что позволяет пациентам быть независимыми и простыми в использовании. Это значительно улучшает качество жизни по сравнению с регулярным посещением клиник для администрирования других маршрутов. Это также улучшает приверженность, поскольку пациенты не сталкиваются с физическими барьерами для приема. Устные маршруты оптимизируют удобство использования в различных условиях ухода от больниц до домов. У них меньше требований к специализированному обучению или оборудованию во время администрирования. Эти преимущества устраняют многие логистические проблемы для пациентов и лиц, осуществляющих уход, что позволяет пероральному лечению стать предпочтительным способом введения. Его удобство обеспечивает большее поглощение по сравнению с другими вариантами администрирования.
По типу молекул, сегмент рекомбинантных слитых белков, как ожидается, станет свидетелем заметного роста в прогнозируемый период.
По типу молекул рекомбинантные сплавные белки вносят наибольшую долю благодаря своей способности использовать биологическую специфичность. Рекомбинантные сплавные белки являются генетически модифицированными комбинациями, которые сохраняют свойства своих родительских молекул. Они могут быть разработаны для нацеливания на конкретные молекулярные маркеры на опухолевые клетки и вызывать индивидуальные действия. Это дает им уникальное преимущество перед другими типами молекул, которым не хватает такой селективности. Точные механизмы рекомбинантного синтеза белка позволяют избежать побочных эффектов и побочных реакций на здоровые ткани, что позволяет повысить эффективность и минимизировать проблемы безопасности. Их консолидированное действие из нескольких молекул обеспечивает улучшенные терапевтические окна. Производители вложили значительные средства в разработку форматов Fusion Protein, таких как иммуноцитокины, чтобы использовать специфичность моноклональных антител и цитотоксический потенциал малых молекул. Беспрецедентная точность обеспечивает лучшие результаты, чем существующие типы модальности, что стимулирует высокий спрос и принятие рекомбинантных термоядерных белков.
Дополнительные идеи Рынок нейроэндокринных опухолей
Трубопровод нейроэндокринных опухолей (НЕТ) отмечен значительными достижениями в терапевтическом развитии. Сети, хотя и редки, являются сложными из-за их гормональной активности и отсутствия ранних симптомов. Подходы к лечению развиваются, и целевые методы лечения, такие как RYZ101 от RayzeBio, предлагают многообещающую потенцию, используя радиоизотопы, такие как актиний-225. Рост онколитической вирусной терапии, представленной Seneca Therapeutics и Vyriad, отражает переход к использованию биологических механизмов для борьбы с опухолевыми клетками с меньшим количеством побочных эффектов. Рынок NET быстро растет, что обусловлено увеличением диагностики и передовыми методами визуализации. Сотрудничество между фармацевтическими компаниями и научными кругами подпитывает исследования новых лекарственных препаратов и терапевтических методов. Однако высокая стоимость лечения и ограниченная доступность узкоспециализированных препаратов являются значительными проблемами. Ожидается, что новые технологии, особенно радиофармацевтика и иммунотерапия, изменят рыночный ландшафт в течение следующего десятилетия.
Обзор конкурентов Рынок нейроэндокринных опухолей
Основными игроками, работающими на рынке нейроэндокринных опухолей, являются RayzeBio, Inc., Seneca Therapeutics, Vyriad, Inc., ADC Therapeutics, Neotropix, Inc., Novartis Pharmaceuticals, Bristol Myers Squibb, Viatris, Thermo Fisher Scientific Inc, Eli Lilly and Company, Biosynthema, Bionano Genomics и GSK Plc.
Рынок нейроэндокринных опухолей Лидеры
- RayzeBio, Inc.
- Сенека Терапевтика
- Vyriad, Inc.
- ADC терапия
- Neotropix, Inc.
Рынок нейроэндокринных опухолей - Конкурентное соперничество

Рынок нейроэндокринных опухолей
(Доминируют крупные игроки)
(Высококонкурентный с большим количеством игроков.)
Последние разработки в Рынок нейроэндокринных опухолей
- В августе 2024 года RayzeBio, Inc. Испытания III фазы для RYZ101, исследовательского радиоизотопа, нацеленного на твердые опухоли. Эта разработка призвана предложить более мощную альтернативу существующим методам лечения с использованием Actinium-225.
- В июле 2024 года Vyriad, Inc. объявила о перспективном Результаты фазы I / II для Voyager-V1, вируса, разработанного для репликации в раковых клетках, показывая синергетические эффекты с существующими иммунотерапиями.
- В июне 2024 года Seneca Therapeutics перенесла свой онколитический вирус SVV-001 на фазу II для лечения NET. SVV-001 избирательно реплицируется в опухолевых клетках, экспрессирующих TEM8, демонстрируя многообещающие ранние результаты в испытаниях.
Рынок нейроэндокринных опухолей Сегментация
- По фазе клинического развития
- Продукты поздней стадии (фаза III)
- Продукция средней стадии (фаза II)
- Продукты ранней стадии (Фаза I)
- Кандидаты на доклиническую и стадию открытия
- По маршруту администрации
- устный
- внутривенно
- подкожный
- родительский
- По типу молекул
- Рекомбинантные белки Fusion
- Маленькая молекула
- моноколониальный Антитело
- пептид
- полимер
- Генная терапия
- Тип продукта
- Моно
- Комбинация
- Моно/комбинация

Хотите изучить возможность покупкиотдельные разделы этого отчета?
Часто задаваемые вопросы :
Насколько велик рынок нейроэндокринных опухолей?
Глобальный рынок нейроэндокринных опухолей оценивается в 4,8 млрд долларов США в 2024 году и, как ожидается, достигнет 7,3 млрд долларов США к 2031 году.
Каким будет CAGR рынка нейроэндокринных опухолей?
Прогнозируется, что CAGR рынка нейроэндокринных опухолей составит 6,2% с 2024 по 31 год.
Каковы основные факторы, влияющие на рост рынка нейроэндокринных опухолей?
Достижения в целенаправленной терапии нейроэндокринных опухолей и повышение осведомленности и ранняя диагностика NET являются основным фактором, стимулирующим рынок нейроэндокринных опухолей.
Каковы ключевые факторы, препятствующие росту рынка нейроэндокринных опухолей?
Высокая стоимость, связанная с целенаправленным лечением и ограниченная эффективность в лечении поздней стадии NET, являются основным фактором, препятствующим росту рынка нейроэндокринных опухолей.
Какова ведущая фаза клинического развития на рынке нейроэндокринных опухолей?
Продукты поздней стадии (Фаза III) являются ведущим сегментом фазы клинического развития.
Какие основные игроки работают на рынке нейроэндокринных опухолей?
RayzeBio, Inc., Seneca Therapeutics, Vyriad, Inc., ADC Therapeutics, Neotropix, Inc., Novartis Pharmaceuticals, Bristol Myers Squibb, Viatris, Thermo Fisher Scientific Inc, Eli Lilly and Company, Biosynthema, Bionano Genomics, GSK Plc - главные игроки.